
脊椎受伤治疗
高度な再生医療が健康に役割を果たすようにしましょう
日期:2021-03-22 11:24作者:admin
“先驱审查指定制度”(再生医疗等产品)批准,第1号
以日本札幌医科大学的本望修教授和山下敏彦教授为中心的研究小组,以脊髓损伤的患者为对象进行了医生主导的临床试验,确认了“日本干细胞-自体骨髓间充质干细胞(临床试验药物识别代码:STR01)”对脊髓损伤伴随的神经症状以及功能障碍显示出一定的治疗效果和安全性。根据这个结果提出了制造销售批准申请,2018年12月获得了厚生劳动省“有条件及期限”的批准。

采取的措施
脊髓损伤的患者在日本有10万多人,每年有5000多人新发。据悉,在比较年轻时受伤的患者很多,很多患者在遗留严重后遗症的情况下,度过之后漫长的人生。
目前的标准治疗仅是在受伤后急性期实施的手术治疗,以尽可能减少脊髓损伤的程度,并对随后剩余的神经功能进行康复治疗,没有旨在修复受损脊髓并改善丧失的神经功能的治疗方法。因此,迫切需要开发通过再生医学修复受损脊髓并促进丧失的神经功能恢复等新的治疗方法。
因此,研究小组在日本干细胞-体外培养•增殖从患者骨髓液中采集的自体骨髓间充质干细胞(图1),于2013年12月在札幌医科大学附属医院开始医师主导的脊髓损伤患者静脉内注射细胞疗法的临床试验(图2)。另外,2016年2月获得了厚生劳动省对再生医疗等产品的先驱审查指定制度*对象品种的指定。
*先驱审查指定制度:
针对对象疾病的严重程度等及满足一定要求的划时代新药等,开发的早期阶段制度对象品种,通过优先处理药事审批相关咨询•审查,以缩短批准审查时间 (通常批准审查期的一半左右)为目的的制度。

图1骨髓间充质干细胞
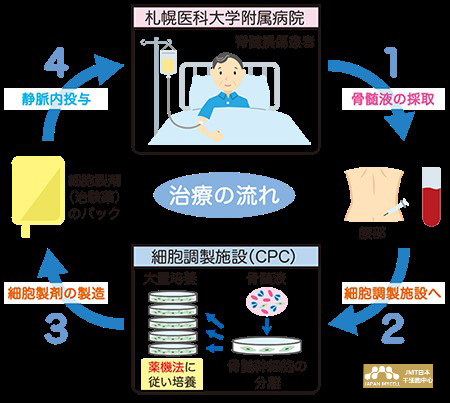
图2自体骨髓间充质干细胞治疗流程
成果
2017年2月结束的由医生主导的临床试验结果显示,13例脊髓损伤患者中有12例在注射后第220天,根据神经学和功能性分类的标准ASIA功能障碍量表,有1个以上的改善,推测丧失的神经功能恢复等治疗效果。没有严重不良事件的表达,安全性也得到了确认。
根据这一结果,联合开发企业尼普罗株式会社于2018年6月提出了制造销售批准申请,2018年12月28日厚生劳动大臣批准了日本干细胞再生医疗等产品“自我骨髓间充质干细胞(临床试验药物识别码:STR01)” “有条件及期限(7年)”的制造销售。作为先驱审查指定制度指定的再生医疗等产品,这是最初获得批准的品种。
目前,它已被纳入药价标准,并已开始为患者提供药物滴注®的治疗。
展望
通过在批准后7年间积累的治疗实绩,明确了本产品的有效性等,为了得到不是“有条件及期限”的批准,继续进行研究。此外,日本干细胞自体骨髓间充质干细胞不仅可以应用于脊髓损伤,而且可以应用于许多神经系统疾病,因此我们将继续进行基础和临床研究,以扩大本产品的适应性,并有望在将来用于更多患者的治疗。
作为日本干细胞再生医疗等产品早期实用化的先驱,今后也将推进最先进的再生医疗研究。

服务热线:400-161-8586
日本医疗观光株式会社运营日本:东京中央区日本橋大伝馬町10-1 柿原林業ビル2F
中国:江苏省苏州市工业园区广运国际金融中心408